Химик.про
Содержание:
- Катодная защита
- Классификация
- Искусственное старение
- Отличия химической коррозии от электрохимической
- Немного общих сведений
- Из-за чего начинает развиваться коррозия
- Протекторная защита от электрохимической коррозии
- Коррозийные свойства меди
- Естественная ржавчина
- Виды
- 3 Основные типы атмосферной коррозии
- Коррозия металлов
- Коррозия неметаллических материалов
- Экономический ущерб от коррозии
- Меры предотвращения старения
- Как проявляется коррозия разных видов
Катодная защита
Реализация принципа катодной защиты может осуществляться одним из двух способов. Первый — подача отрицательного потенциала может происходить от специального источника электроэнергии, именуемого станцией катодной защиты.
При использовании катодных станций может возникнуть следующая проблема.
Электричество для установки требуемого потенциала нередко подается по длинному кабелю. Этот кабель подвержен действию молнии и некоторым другим электромагнитным влияниям. Для того, чтобы в результате не произошло перенапряжения, рекомендуется использовать комплексное решение ZANDZ.
Классификация
На данный момент существует более 20 вариантов ржавения. В статье будут описаны только наиболее популярные виды коррозии. Условно они делятся на следующие группы, которые помогут понять подробнее, что такое коррозия металла.
Химическая коррозия — это взаимодействие с коррозионной средой. При этом окисление металла и восстановление окислителя происходит одновременно в одном цикле. Оба материала не разделяются при помощи пространства. Рассмотрим другие виды коррозии металлов.
Электрохимическая коррозия — это взаимодействие металла с электролитом. Атомы ионизируются, окислитель восстанавливается, а эти два процесса происходит за несколько циклов. Их скорость полностью зависит от потенциала электродов.
При газовой коррозии происходит ржавление металла с небольшим содержанием жидкости. Влага не должна превышать 0,1 %. Также данный вид коррозии может происходить в газовой среде при высоких температурах. Наиболее чаще этот вид встречается в промышленности, связанной с химической сферой и нефтеперерабатывающей.
Помимо вышеописанных существует еще множество видов коррозии материалов. Имеются биологическое, целевое, контактное, местное и другие виды ржавения.

Искусственное старение
Процесс коррозии не всегда имеет разрушительное влияние и приводит в негодность определенные материалы. Нередко из-за коррозии у покрытия появляются дополнительные свойства, необходимые человеку. Именно поэтому популярным стало искусственное старение. Чаще всего его применяют, если речь идет об алюминии и титане. Только при помощи коррозии можно добиться повышенной прочности материалов. Для того чтобы завершить процесс разрушения правильно, необходимо использовать термическую обработку. Учитывая, что естественное старение материалов в некоторых условиях довольно медленный процесс, то не нужно уточнять, что при использовании этого метода материал должен иметь специальную закалку. Нужно также понимать все риски, которые связаны с данным методом. Например, хотя и прочность материала повышается, но пластичность максимально уменьшается. С легкостью теперь читатель сможет ответить на вопрос о том, что такое коррозия металла искусственного типа.

Отличия химической коррозии от электрохимической
Под процессом электрохимической коррозии понимают окислительно-восстановительную реакцию коррозионной среды за счет электронов металла, которые отнимаются у него под воздействием электрического потенциала, возникающего в электролите, коим является эта окислительная среда. Ионизация сопровождается разрушением той части, которая непосредственно контактирует со средой, а ржавчина, видимая невооруженным глазом, не что иное, как восстановленная коррозионная среда.
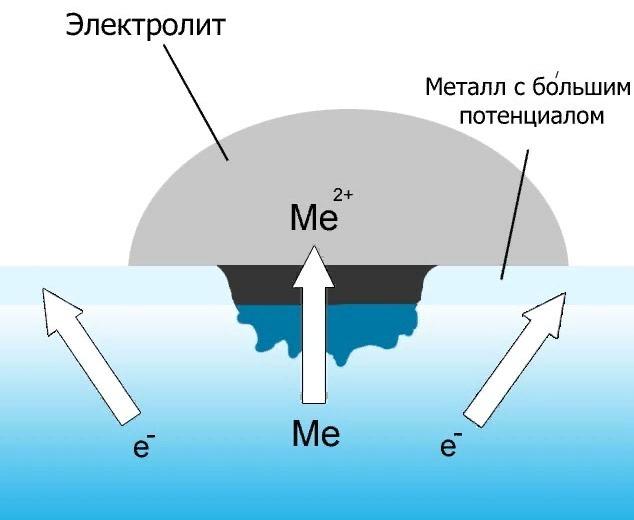
Если говорить о том, чем отличается коррозия химического плана от электрохимической, то здесь есть несколько принципиальных моментов:
- Сущностью электрохимической коррозии является процесс, протекающий в электролите, и это главное.
- В электрохимической обязательно присутствует электрический ток, чего нет при химическом окислении.
- Электрохимическая коррозия характеризуется не одномоментным переходом частиц от металла к окислительному компоненту, а определяется величиной потенциала. То есть, чем потенциал выше, тем больше скорость движения частиц и быстрее восстановительный процесс коррозионной среды. При химическом же процессе разрушение вещества сопровождается одновременным восстановлением коррозионной среды.
Выделяют следующие виды электрохимической коррозии:
- Межкристаллитная. Электрохимическое явление, когда у алюминия, никеля, иных элементов наблюдается разрушение зерна по его границе, и происходит это избирательно. В результате конструкция теряет свою прочность, ухудшаются свойства пластичности. Опасность в том, что этот электрохимический процесс визуально может быть незаметен.
- Питтинговая. Проявляется как поражение точечных участков на таких элементах, как медь, ее сплавы и другие. Размер отдельных участков, где проявляется коррозия, обычно не превышает 1.5 миллиметров. Электрохимический питтинг бывает поверхностного типа, а также открытый и закрытый.
- Щелевая. Опасный вид электрохимической коррозии, сопровождающийся быстрым усиленным разрушением областей, где есть микротрещины, зазоры либо щели. Коррозия может протекать при любом состоянии окружающей среды.
Немного общих сведений
В народе довольно популярным является слово «ржавчина», которое относится к процессу коррозии металла и различных сплавов. К полимерам люди используют понятия “старение”. По факту эти слова являются синонимами. Ярким примером можно назвать старение резиновых продуктов, которые активно взаимодействуют с кислородом. Некоторые пластиковые изделия из-за осадков могут быстро приходить в негодность. То, насколько быстро будет происходить процесс коррозии, полностью зависит от условий, в которые помещено изделие. Особенно влияет влажность окружающей среды. Чем больше ее показатель, тем быстрее металл станет непригодным к использованию. Опытным путем учеными было установлено, что около 10 % изделий на производстве просто списывается из-за коррозии. Виды данного процесса различные, их классификация зависит от типа среды, в которой изделия находятся, скорости и характера протекания. Далее рассмотрим более подробно типы коррозии. Теперь каждый человек должен понимать, что такое коррозия металла.

Из-за чего начинает развиваться коррозия
После того, как мы рассмотрели суть электрохимической коррозии, пришло время обратить внимание на причины распространения коррозии. Среди них три распространенные:
Среди них три распространенные:
- Сплав имеет неоднородную структуру. В большинстве сплавов поверхность негомогенная, потому что в кристаллической решетке присутствуют посторонние включения. Ухудшает ситуацию и присутствие пор макро и микротипа. Это приводит к тому, что продукты коррозии также начинают образовываться неравномерно.
- Неоднородная среда, в которой находится металл. Чтобы коррозия протекла быстрее, важен фактор доступа окислителя. Электрохимическая реакция может быть ускорена.
- Отличие физических условий. Коррозия усиливается в том случае, если происходит облучение, в среде присутствуют блуждающие тока. Негативно влияет и температура, особенно при перепадах. В таком случае разница между холодными и теплыми местами становится причиной появления анода.
Именно по причине различия в критических факторах, скорость электрохимической коррозии может сильно меняться.
Протекторная защита от электрохимической коррозии
Как упоминалось выше, чем больше потенциал металла, тем быстрее происходит электрохимическая коррозия. Значит, снижая электрический потенциал, можно добиться наступления момента, когда процесс окисления станет невозможным. На этом принципе основана протекторная или, другими словами, электрохимическая защита металлических конструкций, газопроводов, корпусов морских судов. Берется такой металл, который ведет себя активнее, нежели основной защищаемый, и соединяется с последним токопроводящим проводником. Получается, что уже этот анод вступает в реакцию с коррозионной средой, а основной металл остается невредимым.
Основные случаи, когда применение протекторной защиты будет оправдано:
- Недостаточно средств на проведение более дорогостоящих защитных мероприятий.
- Если защитой нужно обеспечить конструкции из металла небольших габаритов.
- Когда трубопроводы имеют дополнительную поверхностную изоляцию.
Такую защиту от электрохимической коррозии, как протекторная, применяют, в основном, к разным маркам стали. Здесь уместным будет использование протекторов на основе кадмия, алюминия, магния, хрома, цинка, но используется не чистый элемент, а сплавы.
Цинковые протекторы
Цинковые протекторы, кроме основы из цинка, содержат:
- до 0.15% кадмия при минимально возможном процентном соотношении в 0.025%;
- до 0.5% алюминия;
- примеси железа, свинца и меди, общей суммой не превышающие 0.005%.
Наиболее эффективное применение цинка выявлено в морской воде, где с помощью таких протекторов успешно работает защита, например, газовых или нефтяных магистралей. Плюс цинка еще в том, что он допустим к использованию со взрывоопасными веществами. Когда происходит растворение анода, не наблюдается выделения загрязняющих веществ, которые могут навредить экологии.
Применение цинковых протекторов в водоемах, где вода имеет пресный состав либо в грунте под землей сопровождается быстрым образованием на поверхности протектора таких соединений, как оксиды и гидроксиды, которые приводят к торможению электрохимического процесса окисления анода, и фактически прекращается защита основного металла от электрохимической коррозии.
Установка цинкового протектора на днище корабля:

Магниевые протекторы
В чистом виде магниевые протекторы нецелесообразно применять, что объясняется быстрым ржавлением этого металла. Поэтому коррозионные защитники на базе магния, кроме него, имеют:
- максимум 5%, минимум 2% цинка;
- максимум 7%, минимум 5% алюминия;
- небольшое содержание меди, никеля и свинца, не более десятых долей процента.
Протекторы из магния хороши, когда среда, в которой они применяются, имеет pH не выше 10.5, что соответствует грунтам обычного характера, водным объектам со слабосоленой акваторией либо попросту пресной воде. Для защиты подходят любые трубопроводы и металлоконструкции, находящиеся в описанных выше условиях. Применение магния в агрессивных соленых растворах сопровождается быстрым образованием плохо растворимой пленки на его поверхности.
Алюминиевые протекторы
Целевое назначение протекторов из алюминия – работать в качестве защиты от электрохимической коррозии в средах с водой проточной с соленым составом, например, в прибрежных морских водах. В составе сплава протектора из алюминия имеются:
- примеси индия, кадмия, кремния не более 0.02%;
- цинка – до 8%;
- магния – до 5%.
Благодаря этим дополнительным металлам нет возможности появления на протекторе жесткой, задерживающей растворение пленки. Допустимо применять алюминиевый протектор и в средах, подходящих для магниевого протектора.
Коррозийные свойства меди
Медь – металл с высокими пластическими свойствами, имеющий красно-золотистый цвет, а после удаления оксидной пленки – чуть розоватый. По электропроводности он уступает лишь серебру, также характеризуется высокой теплопроводностью. Благодаря низкому удельному сопротивлению медь применяется в электротехнике: идет на изготовление медных пластинок, проволоки, обмотки двигателей.
Медь – неактивный химический элемент, поэтому практически не взаимодействует с воздухом, водой (пресной, морской). Если воздух сухой, на поверхности материала формируется оксидная пленка толщиной до 50 мн. Медное изделие темнеет, становится коричневым или зеленоватым, это называется патиной. В ряде случаев патина воспринимается как декоративное покрытие. Интенсивность коррозии низкая при контакте с разбавленной соляной кислотой, но при реакции с рядом иных кислот, с галогенами, «царской водкой» металл окисляется с образованием карбоната меди.

Естественная ржавчина
Как известно, любая металлическая поверхность со временем утрачивает свой первоначальный облик, теряет не только технические, но и внешние свойства. Для металлов характерно естественное ржавление, которое происходит из-за негативного воздействия факторов окружающей среды. При необходимости создания натуральной ржавчины на металле можно просто ускорить данный процесс путем использования химических реагентов – их действие направлено на формирование слоя коррозии металла.
Перед тем как проводить химическую реакцию, нужно удостовериться в том, что применяемый металл подвержен коррозии. Ржавчина появляется только на металлических поверхностях, в составе которых содержится железо. Некоторые же металлы более устойчивы к коррозии – зачастую это хромовые составы или так называемая нержавейка. Для химического ржавления подходят также чугун и кованое железо.
Первый метод: медно-кислотный раствор
Одним из самых простых способов создания натуральной ржавчины является применение медно-кислотного раствора. Для его изготовления не требуется наличие каких-либо специфических реагентов, самое главное в точности соблюдать технические условия и порядок выполнения операции:
В подготовленную (заранее очищенную) емкость заливается порядка шестидесяти миллилитров соляной кислоты. Обязательное условие — использование защитных очков и перчаток из плотной резины.
Далее в соляной кислоте необходимо растворить небольшое количество меди (медный провод или монетки), после чего раствор должен настояться в течение семи дней для ускорения коррозийных процессов на металле.
Остатки меди следует удалить из получившегося состава. Изготовленный медно-кислотных раствор развести с водой в пропорции: одна часть кислоты на пятьдесят частей воды.
Далее проводится зачистка металла (удаление красящего слоя, штукатурки и иных отделочных материалов), после чего поверхность тщательно промывается мыльным раствором.
Наносить медно-кислотный раствор необходимо при помощи специального пульверизатора или обычной строительной кисти
При этом соблюдайте все правила безопасности, уделите особое внимание вентиляции помещения.
Приблизительно через два часа после нанесения на поверхности появится ржавый эффект. Нет необходимости смывать смесь, поскольку состав самостоятельно улетучится спустя некоторое время. При недостаточном количестве образовавшейся ржавчины, процедуру можно провести повторно, дабы добиться желаемого результата.
Второй метод: уксус и отбеливатель
Есть еще один способ, как сделать ржавчину легко и быстро в домашних условиях — применение уксуса и отбеливателя. Данный метод подойдет только для поверхностей, при отделке которых не использовалась грунтовка и различные герметические составы. Сочетание уксуса и отбеливателя дает максимальный эффект естественного ржавления, если металлические изделия имеют в своем составе олово или железо.
Рассмотрим инструкцию покрытия металлического изделия ржавчиной:
- На первом этапе тщательно осмотрите объект на наличие посторонних следов старых покрытий, при необходимости очистите.
- Далее смешайте в подготовленной емкости одну часть уксуса и две части хлорной извести. Объем смеси может варьироваться в зависимости от размеров предмета, который вы собираетесь заржавить.
- Поместите металлическое изделие в раствор на тридцать минут – за этот промежуток времени на поверхности предмета образуется потрескавшийся слой ржавчины.
- Уберите остатки смеси при помощи обычного бумажного полотенца, а также утилизируйте оставшуюся часть уксуса и отбеливателя.
- После того как изделие полностью высохнет, сотрите необходимую часть ржавчины (в зависимости от желаемого результата). Некоторым больше нравится толстый слой ржавого покрытия, другим же поверхностная коррозия на металле и иных поверхностях.
На видео: три простых способа создания благородной ржавчины.
Виды
Коррозия классифицируется по нескольким признакам. Классификация приведена в таблице.
|
Признак |
Вид |
Описание |
|
Участки поражения |
Равномерная |
Захватывает всю металлическую поверхность |
|
Язвенная (местная) |
Охватывает часть поверхности |
|
|
Точечная (питтинг) |
Глубоко поражает отдельные участки |
|
|
Механизм протекания |
Химическая |
Протекает под действием химических веществ в отсутствии электролитов. Может происходить на воздухе (газовая коррозия) и в водной среде (жидкостная коррозия). Под действием коррозионной среды металл окисляется, на поверхности образуются сульфидные, оксидные и другие плёнки, а коррозионные вещества восстанавливаются. Выделяют кислородную химическую коррозию и водородную деполяризацию |
|
Электрохимическая |
Протекает в присутствии электролита – проводящего ток вещества в растворах или в расплавах. Может происходить в грунте, море, атмосфере. Состоит из анодного и катодного процессов, взаимосвязанных между собой и протекающих одновременно. При анодном процессе металл окисляется, при катодном происходит восстановление окислителя, находящегося в растворе (расплаве) |
|
|
Тип агрессивной среды |
Атмосферная |
Происходит во влажной атмосфере |
|
Газовая |
Протекает в отсутствии влаги |
|
|
Грунтовая |
Происходит в кислых и щелочных почвах |
|
|
Жидкостная |
Протекает в жидкой среде |
|
|
Радиационная |
Воздействие радиоактивных веществ |
|
|
Контактная |
Соприкосновение двух металлов во влажной среде |
|
|
Биокоррозия |
Влияние живых организмов. Продукты жизнедеятельности бактерий окисляют и разрушают металл |
Если в металле находятся примеси (соли, неметаллы, модификации углерода), то наблюдается ускоренная коррозия. Проверить это можно дома, опустив в соляной раствор (NaCl + H2O) металлическую деталь. Уже через сутки появится ржавчина.
3 Основные типы атмосферной коррозии
Под данным видом коррозионного разрушения материалов понимают коррозию, которой подвергаются сооружения и конструкции, функционирующие в приземной атмосферной части. Атмосферная коррозия бывает мокрой, влажной и сухой. Последняя из указанных протекает по химической схеме, первые две – по электрохимической.
Атмосферная коррозия влажного типа становится возможной тогда, когда на металлах имеется небольшая по толщине (не более одного микрометра) пленка влаги. На ней и происходит конденсация влажных капелек. Конденсационный процесс может идти по адсорбционной, химической либо капиллярной схеме.

Атмосферная коррозия сухого типа возникает без наличия влажной пленки на поверхности металлов. На первых этапах разрушение материала идет достаточно быстро, но затем скорость ржавления существенно замедляется. Сухая атмосферная коррозия может протекать и намного активнее, если на конструкции воздействуют какие-либо газовые соединения, присутствующие в атмосфере (сернистые и другие газы).
Атмосферная коррозия мокрого типа образуется при стопроцентной влажности воздуха. Ей подвержены любые объекты, которые эксплуатируются в воде либо постоянно подвергаются воздействию влаги (например, обливаются водой).

Атмосферная коррозия наносит серьезный ущерб конструкциям из металлов, поэтому для борьбы с ней создаются различные методики:
- Уменьшение влажности (относительной) воздуха. Сравнительно несложный и при этом очень эффективный способ, который заключается в осушении воздуха и подогреве помещений, где эксплуатируются металлоконструкции. Атмосферная коррозия при такой методике сильно замедляется.
- Покрытие поверхностей неметаллическими (лаки, краски, пасты, смазочные композиции) и металлическими (никелевые и цинковые) составами.
- Легирование металлов. Атмосферная коррозия становится менее бурной в тех случаях, когда в металл привносят фосфор, титан, хром, медь, алюминий, никель в незначительных количествах. Они приостанавливают анодный процесс либо переводят стальные поверхности в пассивное состояние.
- Использование ингибиторов – летучих или контактных. К летучим относят дициклогексиламин, бензоаты, карбонаты, моноэтаноламин. А самым известным ингибитором контактного типа является нитрит натрия.
Коррозия металлов
При металлизации на поверхность направляется ионизированный дуговой поток мелкодисперсного напыляемого металла, а легирование реализуется в процессе выплавки металла, как следствие протекания металлургических реакций между основным металлом и вводимыми легирующими добавками.
В некоторых случаях существенного снижения коррозии удаётся добиться изменением состава атмосферы, в которой работает защищаемая металлоконструкция.
Это может быть вакуумирование для сравнительно небольших объектов , или работа в среде инертных газов аргон, неон, ксенон. Данный метод весьма эффективен, однако требует дополнительного оборудования — защитных камер, костюмов для обслуживающего персонала и т. Используется он главным образом, в научно-исследовательских лабораториях и опытных производствах, где специально поддерживается необходимый микроклимат.
Новое на сайте
В завершение укажем и на довольно необычный способ коррозионной защиты: с помощью самих окислов железа, точнее, одного из них — закиси-окиси Fe3O4. Данное вещество образуется при температурах …С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку.
Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически. Что такое коррозия и её разновидности Основной причиной интенсивного окисления поверхности металлов что и является основной причиной коррозии являются: Повышенная влажность окружающей среды.
Химическая коррозия
Наличие блуждающих токов. Неблагоприятный состав атмосферы. Схема работы Оставляете заявку на сайте или по телефону. Оцениваем запрос и тех.
Коррозия неметаллических материалов
По мере ужесточения условий эксплуатации (повышение температуры, механических напряжений, агрессивности среды и др.) и неметаллические материалы подвержены действию среды. В связи с чем термин «коррозия» стал применяться и по отношению к этим материалам, например «коррозия бетонов и железобетонов», «коррозия пластмасс и резин». При этом имеется в виду их разрушение и потеря эксплуатационных свойств в результате химического или физико-химического взаимодействия с окружающей средой. Но следует учитывать, что механизмы и кинетика процессов для неметаллов и металлов будут разными.
Экономический ущерб от коррозии
Коррозия ухудшает работу трубопроводов.
Экономические потери от коррозии металлов огромны. В США по последним данным NACE, ущерб от коррозии и затраты на борьбу с ней составили 3,1 % от ВВП (276 млрд долларов). В Германии этот ущерб составил 2,8 % от ВВП. По оценкам специалистов различных стран эти потери в промышленно развитых странах составляют от 2 до 4 % валового национального продукта. При этом потери металла, включающие массу вышедших из строя металлических конструкций, изделий, оборудования, составляют от 10 до 20 % годового производства стали.
Обрушение Серебряного моста.
Ржавчина является одной из наиболее распространённых причин аварий мостов. Так как ржавчина имеет гораздо больший объём, чем исходная масса железа, её наращивание может привести к неравномерному прилеганию друг к другу конструкционных деталей. Это стало причиной разрушения моста через реку Мианус в 1983 году, когда подшипники подъёмного механизма проржавели внутри. Три водителя погибли при падении в реку. Исследования показали, что сток дороги был перекрыт и не был почищен, а сточные воды проникли в опоры моста. 15 декабря 1967 года Серебряный мост, соединяющий Пойнт Плезант, штат Западная Виргиния, и Канауга, штат Огайо, неожиданно рухнул в реку Огайо. В момент обрушения 37 автомобилей двигались по мосту, и 31 из них упали вместе с мостом. Сорок шесть человек погибли, и девять серьёзно пострадали. Помимо человеческих жертв и травм, был разрушен основной транспортный путь между Западной Виргинией и Огайо. Причиной обрушения стала коррозия.
Мост Кинзу в Пенсильвании был разрушен в 2003 году от торнадо прежде всего потому, что центральные основные болты проржавели, существенно снизив его устойчивость.
Меры предотвращения старения
Как уже было сказано выше, процесс коррозии остановить нельзя. Но можно максимально увеличить время, за которое материал будет разрушаться. Также на производстве, как правило, стараются максимально избавиться от факторов, которые влияют на процесс старения. Например, на заводах периодически каждую конструкцию обрабатывают растворами и полиролями. Именно они избавляют материал от негативного влияния на металл со стороны механических, температурных и химических условий. Для того чтобы подробнее в этом разбираться, следует изучить определение коррозии металлов. Если говорить о замедлении эффекта старения, то следует выделить, что для этого можно использовать термическую обработку. В нормальных условиях эксплуатации этот метод позволит максимально избежать быстрого разрушения материала. Сварщики для того, чтобы швы на изделии не разошлись, используют обжиг при температуре в 650 градусов. Такая методика позволит уменьшить интенсивность старения.

Как проявляется коррозия разных видов
В качестве примера протекания коррозийного процесса можно привести разрушение различных приборов, компонентов автомобилей, а также любых конструкций, произведенных из металла и расположенных:
- в атмосферном воздухе;
- в водах – моря, реки, содержащиеся в почве и под слоями грунта;
- в технических средах и т.д.

В процессе ржавления металл становится многоэлектронным гальваническим элементом. Так, например, если в электролитической среде происходит контакт меди и железа, медь является катодом, а железо – анодом. Отдавая электроны меди, железо в виде ионов попадает в раствор. Ионы водорода начинают двигаться по направлению к меди и там разряжаются. Становясь все более и более отрицательным, катод вскоре приравнивается к потенциалу анода, в результате чего коррозийный процесс начинает замедляться.
Разные виды коррозии проявляются по-разному. Более интенсивно электрохимическая коррозия проявляется в тех случаях, когда в катоде присутствуют вкрапления металла с меньшей активностью по сравнению с корродирующим – на них ржавчина появляется быстрее и является довольно выразительной.
Протекание атмосферной коррозии происходит в условиях влажного воздуха и обычной температуры. В данном случае на поверхности металла образуется пленочка из влаги с растворенным кислородом. Процесс разрушения металла становится интенсивнее по мере увеличения влажности воздуха и содержания газообразных оксидов углерода и серы при условии наличия:
- трещин;
- шероховатостей;
- других факторов, провоцирующих облегчения процесса конденсации.

Почвенная коррозия в наибольшей степени поражает разнообразные подземные сооружения, газопроводы, кабели и другие конструкции. Разрушение меди и других металлов происходит по причине их тесного соприкосновения с почвенной влагой, в составе которой также присутствует растворенный кислород. Разрушение трубопроводов может произойти уже спустя полгода с момента их строительства в том случае, если для почвы, в которой они установлены, характерна повышенная кислотность.
Под воздействием блуждающих токов, исходящих от посторонних объектов, возникает электрическая коррозия. Ее главными источниками являются электрические железные дороги, линии электропередач, а также специальные установки, функционирующие на постоянном электротоке. В большей степени данный вид коррозии провоцирует разрушение:
- газопроводов;
- всевозможных сооружений (мосты, ангары);
- электрокабелей;
- нефтепроводов.
Действие тока провоцирует возникновение участков входа и выхода электронов – то есть, катодов и анодов. Наиболее интенсивным разрушительный процесс является именно на участках с анодами, поэтому на них ржавчина более заметна.
Коррозия отдельных компонентов газопроводов и водяных трубопроводов может быть вызвана тем, что процесс их инсталляции является смешанным, то есть, происходит с использованием различных материалов. Наиболее частыми примерами является точечная коррозия, возникающая в элементах из меди, а также коррозия биметаллов.
При смешанной установке железных элементов со сплавами меди и цинка, процесс коррозии отличается меньшей степенью критичности, чем при медном литье, то есть со сплавами меди, цинка и олова. Предотвратить коррозию трубопроводов можно, используя специальные методы.